Främjande av tillgången till läkemedel och medicintekniska produkter

FN:s mål 3 för hållbar utveckling:

3.4 Genom förebyggande insatser och behandling fram till 2030 minska antalet människor som dör i förtid av icke smittsamma sjukdomar med en tredjedel samt främja psykisk hälsa och välbefinnande.
3.8 Skapa tillgång till allmän hälso- och sjukvård som även skyddar mot ekonomiska risker, tillgång till högkvalitativa och väsentliga hälso- och sjukvårdstjänster samt säkra, effektiva, högklassiga och förmånliga nödvändiga läkemedel och vaccinationer för alla.
Utmaning
Förenta nationerna (FN) har fastställt dödligheten som orsakas av hjärt- och kärlsjukdomar, cancer, diabetes och sjukdomar i andningsorganen som en av indikatorerna för ett hälsosamt liv och välbefinnande. Även Världshälsoorganisationen WHO har publicerat ett åtgärdsprogram i syfte att förebygga kroniska folksjukdomar. I Finland betraktas bland annat hjärt- och kärlsjukdomar, diabetes, astma och allergi samt cancersjukdomar som kroniska, dvs. som långvariga folksjukdomar. Det finns emellertid effektiva läkemedel mot dessa sjukdomar.
Störningar i tillgången till läkemedel är ett globalt växande fenomen och även små marknadsområden som Finland har utmaningar med tillgången till läkemedel. Antalet störningar i tillgången som anmälts till Fimea har ökat under de senaste tio åren. En del av problemen med tillgången beror på faktorer som Finland har mycket begränsade möjligheter att påverka. Dessa är till exempel globaliseringen av läkemedels- och råvarutillverkningen och komplicerade läkemedelskedjor. Störningar i tillgången kan till exempel bero på produktions- eller logistikproblem, brist på råvaror, överraskande variationer i efterfrågan eller kommersiella faktorer. Avbrott i tillgången till läkemedel syns oftast inte ända fram till patienten, eftersom det ofta finns ett motsvarande preparat som omfattas av läkemedelsutbyte och som apoteket kan expediera.
Innehavaren av försäljningstillståndet för ett läkemedel, dvs. läkemedelsföretaget, ansvarar för att ett preparat som beviljats försäljningstillstånd hela tiden finns tillgängligt för läkemedelspartiaffärer och apotek för att möta patienternas och andra användares behov. Detta är också ett lagstadgat villkor i samband med beviljande av försäljningstillstånd.
Fimeas roll
Utvärderingen av läkemedel samt säkerställandet av en ändamålsenlig läkemedelstillverkning och -distribution är Fimeas grundläggande uppgift som vi övervakar och främjar på många olika sätt. Fimea beviljar försäljningstillstånd för humanläkemedel och veterinärmedicinska läkemedel både i egenskap av nationell beslutsfattare och i samarbete med andra läkemedelsmyndigheter inom EU. Fimea utövar också tillsyn över medicintekniska produkters överensstämmelse med kraven och över aktörerna inom branschen i Finland. Dessutom säkerställer Fimea att apotekstjänsterna är tillräckliga, att läkemedlen levereras och distribueras säkert samt att priskonkurrensen fungerar för att trygga konsumentens ställning.
Fimea påverkar aktivt EU:s läkemedelsstrategi och läkemedelstillsyn. Genom effektiv tillsyn säkerställs läkemedlens säkerhet och kvalitet samt att distributionen och expedieringen är ändamålsenliga. En rätt riktad, effektiv och effektfull insyn över läkemedelsförsörjningen och distributörerna av medicintekniska produkter utgör grunden för att säkerställa patientsäkerheten samt människors och djurs välbefinnande.
Fimeas mål
Fimeas mål är att på ett hållbart sätt främja medborgarnas hälsa och välfärd samt säkerställa att medborgarna har tillgång till trygga, effektiva, högklassiga och förmånliga nödvändiga läkemedel och vaccinationer. Fimea strävar också efter att vara den primära och aktuella informationskällan när det gäller störningar i tillgången. Målet är att störningar i tillgången till läkemedel och medicintekniska produkter ska påverka patientbehandlingarna så lite som möjligt på nationell nivå.
Hur Fimea främjar uppnåendet av målet
- Fimea utvärderar och beviljar försäljningstillstånd för humanläkemedel och veterinärmedicinska läkemedel. Antalet utvärderingar som Fimea gjort i egenskap av ansvarigt rapporterings- eller parallellrapportörsland för centraliserade försäljningstillstånd, som koordineras av Europeiska läkemedelsmyndigheten, är betydande med tanke på myndighetens storlek, vilket främjar Fimeas internationella effektfullhet. Fimea är en föregångare i synnerhet när det gäller utvärdering av försäljningstillstånd för biosimilarer: år 2023 utvärderade Finland som ansvarigt rapporteringsland näst flest ansökningar om försäljningstillstånd för biosimilarer av EU-länderna.
- I sin strategi betonar Fimea vikten av att trygga tillgången till synonympreparat och att utöka sortimentet. Fimea har fortsatt att satsa på tillgången till synonympreparat genom att fungera som ansvarig referensmedlemsstat för dem i en betydande del av EU:s gemensamma behandlingar av ansökningar.
| Läkemedelspreparat Sort the table ascending by the column | 2018 Sort the table ascending by the column | 2019 Sort the table ascending by the column | 2020 Sort the table ascending by the column | 2021 Sort the table ascending by the column | 2022 Sort the table ascending by the column | 2023 Sort the table ascending by the column |
|---|---|---|---|---|---|---|
| Humanläkemedel | 9 224 | 9 515 | 9 584 | 9 867 | 10 059 | 10 311 |
| Veterinärmedicinskt läkemedel | 1 030 | 1 080 | 1 131 | 1 163 | 1 192 | 1 215 |
| Sammanlagt | 10 254 | 10 595 | 10 715 | 11 030 | 11 252 | 11 526 |
- Fimea uppmuntrar med hjälp av lagstiftningen utvecklingen av läkemedel för barn så att tillgången till läkemedel för barn förbättras.
- Fimea sörjer för tillgången till läkemedelspreparat som behövs för sexuell och reproduktiv hälsa (till exempel preventivmedel, behandling av barnlöshet och könssjukdomar), vilket också främjar jämställdhet och likabehandling.
- Fimea övervakar medicintekniska produkters överensstämmelse med kraven och aktörerna inom området. Tillsynen över produkternas överensstämmelse med kraven gäller medicintekniska produkter som släppts ut på marknaden samt deras professionella användning och underhåll. Fimea beviljar medicintekniska produkter exportintyg, forsknings- och undantagstillstånd.
Anmälda organ för medicintekniska produkter
Innan en medicinteknisk produkt släpps ut på marknaden i Europa ska den genomgå en sådan bedömning av överensstämmelse med kraven som beskrivs i EU-förordningarna. Till skillnad från läkemedel har CE-märkta medicintekniska produkter inget försäljningstillstånd som beviljats av myndigheterna, utan de bedöms av de anmälda organen. De anmälda organen är självständiga aktörer som bedömer överensstämmelsen med kraven. Fimea utser anmälda organ som är verksamma i Finland och övervakar deras verksamhet.
De anmälda organen har en kritisk roll i processen för att släppa ut produkter på marknaden. De är en viktig del av systemet för att säkerställa tillgången till, kvaliteten på och säkerheten hos medicintekniska produkter. I Finland finns för närvarande två anmälda organ enligt förordningen om medicintekniska produkter (MDR EU 2017/745) och 2023 fick Finland också två anmälda organ enligt förordningen om in vitro-diagnostik (IVDR EU 2017/746). I hela EU finns 40 anmälda organ för produkter enligt MD-förordningen och 12 anmälda organ för produkter enligt IVD-förordningen.
- Fimea övervakar säkerheten hos humanpreparat, till exempel blod och blodpreparat, vävnader, organtransplantat och läkemedelspreparat som används i avancerade terapier (ATMP) och aktörer inom branschen. Fimea beviljar tillstånd för blod- och vävnadsinrättningar och ansvarar för regelbunden inspektion av inrättningarna.
Fallexempel: Förnyande av kriterierna för godkännande av blodgivare
Fimeas förnyade föreskrift om blodtjänstverksamhet trädde i kraft i oktober 2023.
I den nya föreskriften ändrades lämplighetskriterierna för blodgivning så att det tillfälliga blodgivningsförbudet efter sex mellan män avlägsnades. Sex med en ny partner eller flera partner medför alltid ett tillfälligt blodgivningsförbud på fyra månader.
Dessutom utfärdades ett tillfälligt blodgivningsförbud som berörde bland annat vissa infektioner eller exponering för dem, exponering för sjukdom som smittar via blodet samt vissa vaccinationer.
Upphävandet av det tillfälliga förbudet mot blodgivning efter sex mellan män är av betydelse för medborgarnas jämlikhet. Personer som lever i ett långvarigt, etablerat parförhållande kan nu donera blod oberoende av sin sexuella läggning.
- Fimea beviljar tillstånd för bland annat apotek samt för nationella läkemedelsfabriker och läkemedelspartiaffärer samt inspekterar aktörer regelbundet. Utöver de inhemska läkemedelsfabrikerna inspekterar Fimea även läkemedelsfabriker i så kallade tredjeländer som importerar läkemedel till EU/EES-området. För att varje sektor ska övervakas tillräckligt följer Fimea upp antalet inspektioner av olika aktörer på årsnivå.
| År Sort the table ascending by the column | 2021 Sort the table ascending by the column | 2022 Sort the table ascending by the column | 2023 Sort the table ascending by the column |
|---|---|---|---|
| Läkemedelsfabriker GMP | 30 | 31 | 34 |
| Blodtjänstverksamhet | 4 | 6 | 5 |
| Sjukhusapotek och läkemedelscentraler | 18 | 18 | 14 |
| Apotek och filialapotek | 28 | 36 | 55 |
| Läkemedelspartiaffärer | 25 | 27 | 26 |
| Vävnadsinrättningar | 25 | 25 | 22 |
| Organdonations- och transplantationsverksamhet | 0 | 6 | 6 |
| Inspektion av tillverkare av medicintekniska produkter | 9 | 9 | 19 |
| Inspektion av auktoriserade representanter för, importörer och distributörer av medicintekniska produkter | 2 | 3 | 4 |
| Inspektion av platser för kliniska prövningar av produkter | 0 | 2 | 1 |
| Årlig tillsyn över anmälda organ | 3 | 3 | 3 |
| Inspektion av producenter av steriliseringstjänster | 0 | 0 | 0 |
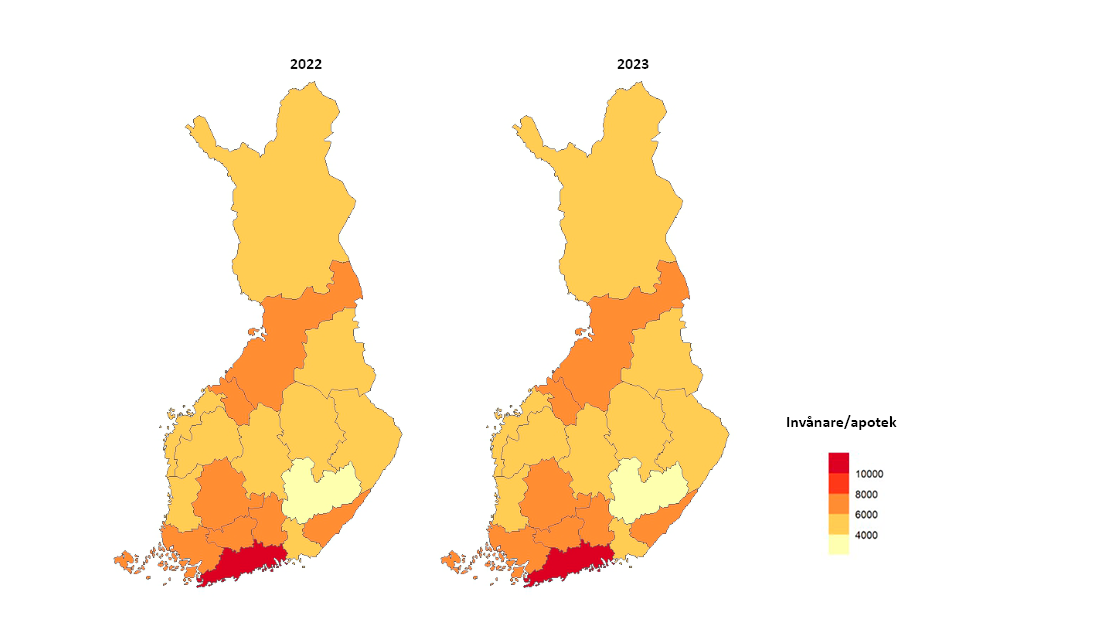
- Vad gäller apotekstjänster är antalet aktörer begränsat i Finland. Apoteken utvecklar nya serviceformer som främjar tillgången till läkemedel, till exempel nätapoteksverksamhet och hemtransporttjänster. Fimea säkerställer att Finlands apoteksnät är tillräckligt täckande, det vill säga att nätverket av apotek utvecklas enligt kundernas behov och att tillgången till läkemedel är god även på glesbygden. Fimea utvärderar årligen distributionsnätets omfattning och följer upp antalet apoteksverksamhetsställen per invånare och kommun. Den 31 december 2023 fanns det sammanlagt 640 apotek och 189 filialapotek i Finland. Vid 107 apotek byttes apotekare och vid sju apotek som Fimea grundat tidigare valdes den första apotekaren.
- Fimea sörjer för det omfattande läkemedelsutbud som hälso- och sjukvården behöver, följer upp antalet beviljade försäljningstillstånd och prispolitiken för läkemedel. Fimea upprätthåller till exempel en så kallad förteckning över utbytbara läkemedel. Utbytbara läkemedel innehåller en lika stor mängd av samma verksamma läkemedelssubstans, varvid läkemedlet kan bytas ut mot det billigaste utbytbara läkemedlet på apoteket. Preparat till förmånligare pris, till exempel generiska läkemedel och biosimilarer, möjliggör en ekonomiskt hållbar tillgång till läkemedel och ger hälsofördelar för en så stor del av befolkningen som möjligt. Från och med början av april 2023 blev de inhalerbara läkemedelspreparat som används vid behandling av astma och kronisk obstruktiv lungsjukdom utbytbara. Läkemedelsutbytet effektiverades för att öka priskonkurrensen mellan preparaten i syfte att förbättra läkemedelsförsörjningens kostnadseffektivitet.
| Summa Sort the table ascending by the column | 2017 Sort the table ascending by the column | 2018 Sort the table ascending by the column | 2019 Sort the table ascending by the column | 2020 Sort the table ascending by the column | 2021 Sort the table ascending by the column | 2022 Sort the table ascending by the column |
|---|---|---|---|---|---|---|
| Totalt, miljoner euro | 70,1 | 77,8 | 75,5 | 75,1 | 78,2 | 102,3 |
| Besparing/byte, euro | 23,7 | 22,9 | 19,0 | 18,2 | 16,7 | 21,2 |
Källor: FPA:s (Folkpensionsanstalten) material Expedierade recept som ersätts av sjukförsäkringen. Pris- och referensprisuppgifter från uppgifterna i Läkemedelsdatabasen. Ersättningarna inkluderar tilläggsersättningar. Statistiken omfattar också inköp som gjorts innan initialsjälvrisken uppfyllts.
Besparingar som utbyte av läkemedel medfört 2017–2022 i tillgänglig form (PDF).
- Läkemedelsföretaget ansvarar för informationen om tillgången till ett läkemedel och om utsläppande på marknaden. Fimea övervakar och utreder vid behov störningar i tillgången till läkemedel tillsammans med läkemedelsföretagen. Fimea upprätthåller på sin webbplats en förteckning över aktuella störningar i tillgången som grundar sig på uppgifter från läkemedelsföretag. År 2023 tog Fimea i bruk ett register och elektronisk ärendehantering för att behandla anmälningar om störningar i tillgången till läkemedel från läkemedelsföretag. Under 2024 utvecklas rapporteringen om lägesbilden av tillgången till läkemedel och beredskapen. Uppgifter om tillgången från olika informationskällor, även uppgifter i anmälningar om störningar i tillgången, sammanställs i rapporter för de nationella och EU-myndigheternas behov.
Fimea påverkar aktivt i Europeiska läkemedelsmyndighetens (EMA) nätverk och arbetsgrupper för hantering av tillgången till läkemedel. År 2023 deltog Fimea till exempel i utarbetandet av EU:s förteckning över kritiska läkemedel, genom vilken man strävar efter att förebygga leveransproblem som är särskilt skadliga för patientvården. Ett läkemedel bedöms vara kritiskt om det används vid allvarliga sjukdomar och inte lätt kan ersättas av andra läkemedel.
Fimea ledde år 2023 ett delprojekt inom EU:s samarbetsprojekt. Målet med det delprojekt som Fimea ledde är att förebygga störningar i tillgången och förhindra att störningarna får konsekvenser för patienterna. Målet är att harmonisera hanteringen av tillgången till läkemedel mellan läkemedelsmyndigheterna så att störningar i tillgången till läkemedel påverkar patientbehandlingarna så lite som möjligt på nationell nivå.
År 2023 effektiviserade Fimea också den interna distributionen av information om störningar i tillgången och tillgången till läkemedel. - Fimea deltar i samarbetet för hantering av tillgången till medicintekniska produkter. Europeiska läkemedelsmyndigheten EMA inrättade i juni 2023 en arbetsgrupp för hantering av tillgången till medicintekniska produkter, SPOC (Medical Device Shortages Single Point of Contact, på engleska), som även Fimea gick med i.
SPOC-arbetsgruppen grundades för att ge rekommendationer till styrgruppen för hantering av tillgången till medicintekniska produkter MDSSG (Excecutive Steering Group on Shortages of Medical Devices) i ärenden som direkt eller indirekt anknyter till brister i eller problem med tillgången till medicintekniska produkter i exceptionella situationer som berör folkhälsan. År 2023 utvecklades EU:s gemensamma användargränssnitt för uppföljning och rapportering av störningar i tillgången till medicintekniska produkter. - Fimea övervakar den obligatoriska lagringen, vars syfte är att trygga tillgången till läkemedel i störningssituationer där den normala tillgången till läkemedel till vårt land har försvårats eller är förhindrad på grund av till exempel leveransstörningar eller en allvarlig kris. Vid behov kan Fimea själv bevilja eller föreslå att social- och hälsovårdsministeriet beviljar tillstånd för läkemedelsföretag att underskrida den obligatoriska lagringen för att trygga en obruten distribution av läkemedelspreparat eller bli befriade från den obligatoriska lagringen.
Genomförandet av den obligatoriska lagringen övervakas vid inspektioner av aktörer som är skyldiga att ha ett obligatoriskt lager. Apoteken är skyldiga att lagra den mängd läkemedelspreparat som motsvarar förbrukningen inom sin vanliga kundkrets under två veckor. Fimea övervakar genomförandet av detta vid apoteksinspektioner. - Fimea deltar i den nationella beredskapsverksamheten. Fimea deltog i verksamheten vid delegationen för social- och hälsovården under undantagsförhållanden (Delegationen för social- och hälsovården under undantagsförhållanden PONK) både i fråga om läkemedel och medicintekniska produkter. Delegationen för social- och hälsovården under undantagsförhållanden är en delegation som tillsätts av social- och hälsovårdsministeriet och vars uppgift är att främja beredskapen för undantagsförhållanden inom social- och hälsovården samt miljö- och hälsoskyddet. Delegationen lägger fram förslag till sådana arrangemang inom social- och hälsovården under normala förhållanden som stöder verksamheten även under undantagsförhållanden.
- Fimea beviljar special- eller undantagstillstånd för att säkerställa att läkemedelsbehandlingen inte avbryts i situationer där ett kritiskt läkemedelspreparat med försäljningstillstånd inte finns att tillgå i Finland. Specialtillståndsförfarandet tryggar enskilda patienters läkemedelsbehandling i undantagsfall då man genom särskilda sjukvårdsrelaterade orsaker beviljar tillstånd för ett sådant läkemedelspreparat som inte har försäljningstillstånd i Finland.
| Prestation Sort the table ascending by the column | 2020 Sort the table ascending by the column | 2021 Sort the table ascending by the column | 2022 Sort the table ascending by the column | 2023 Sort the table ascending by the column |
|---|---|---|---|---|
| Anmälningar om störningar i tillgången | 2 093 | 1 710 | 2 335 | 2 849 |
| Beslut om obligatorisk lagring | 391 | 313 | 478 | 494 |
| Beslut om rätt att få underskrida lagervolymen vid obligatorisk lagring | 312 | 270 | 441 | 450 |
| Ansökningar om undantagstillstånd (humanläkemedel)* | 198 | 125 | 175 | 200 |
| Beslut om undantagstillstånd (humanläkemedel)* | 189 | 107 | 152 | 186 |
| Inkomna ansökningar om undantagstillstånd (veterinärmedicinska läkemedel)* | 33 | 49 | 60 | 46 |
| Beslut om undantagstillstånd (veterinärmedicinska läkemedel)* | 31 | 46 | 53 | 39 |
| Beslut om patientspecifika specialtillstånd | 7 327 | 6 809 | 7 402 | 8 917 |
| Beslut om anläggningsspecifika specialtillstånd | 8 465 | 7 730 | 8 019 | 7 926 |
| Tidsbundna beslut om specialtillstånd | – | – | 110 | 81 |
| Undantagstillstånd för medicintekniska produkter (MD-förordningen och IVD-förordningen) | – | 1 | 14 | 10 |
Fimea följer upp olika prestationer som påverkar tillgången till läkemedel, till exempel anmälningar om störningar i tillgången, antalet tillstånd att underskrida den obligatoriska lagringen av läkemedelspreparat samt antalet undantagstillstånd och specialtillstånd.
* I fråga om undantagstillstånd har beräkningssättet ändrats och därför är siffrorna inte direkt jämförbara med tidigare års antal.
Antalet prestationer i anslutning till hantering av tillgången till läkemedel och medicintekniska produkter 2020–2023 i tillgänglig form (PDF).