Lääkkeiden ja lääkinnällisten tuotteiden saatavuuden edistäminen

YK:n kestävän kehityksen tavoite 3:

3.8 Saavuttaa yleiskattava terveydenhuolto, mukaan lukien turva taloudellisilta riskeiltä, pääsy laadukkaiden ja olennaisten terveydenhoitopalvelujen piiriin sekä turvalliset, tehokkaat, laadukkaat ja edulliset välttämättömät lääkkeet ja rokotukset kaikille.
Haaste
Yhdistyneet Kansakunnat (YK) on asettanut sydän- ja verisuonisairauksiin, syöpiin, diabetekseen ja hengityselinsairauksiin liittyvän kuolleisuuden yhdeksi terveellisen elämän ja hyvinvoinnin indikaattoriksi. Myös Maailman terveysjärjestö WHO on julkaissut toimenpideohjelman kroonisten kansantautien ehkäisemiseksi. Suomessa muun muassa sydän- ja verisuonisairaudet, diabetes, astma ja allergia sekä syöpäsairaudet katsotaan kroonisiksi eli pitkäaikaisiksi kansantaudeiksi. Kyseisiin sairauksiin on kuitenkin olemassa tehokkaita lääkkeitä.
Lääkkeiden saatavuushäiriöt ovat maailmanlaajuisesti kasvava ilmiö ja myös Suomen kaltaisilla pienillä markkina-alueilla on haasteita lääkkeiden saatavuudessa. Fimealle ilmoitettujen saatavuushäiriöiden määrä on kasvanut viimeisen kymmenen vuoden aikana. Osa saatavuusongelmista johtuu tekijöistä, joihin Suomesta käsin voidaan vaikuttaa hyvin rajallisesti. Näitä ovat esimerkiksi lääke- ja raaka-ainevalmistuksen globalisaatio ja monimutkaiset lääkeketjut. Saatavuushäiriöt voivat johtua esimerkiksi tuotanto- tai logistiikkaongelmista, raaka-ainepulasta, yllättävästä kysynnän vaihtelusta tai kaupallisista syistä. Katkokset lääkkeiden saatavuudessa eivät useimmiten näy potilaalle asti, sillä usein saatavilla on vastaava (lääkevaihdon piirissä oleva) valmiste, jonka apteekki voi toimittaa.
Lääkkeen myyntiluvanhaltijan eli lääkeyrityksen vastuulla on huolehtia, että myyntiluvan saanutta valmistetta on jatkuvasti lääkkeiden tukkukauppojen ja apteekkien saatavissa potilaiden ja muiden käyttäjien tarpeisiin. Tämä on myös myyntiluvan myöntämisen yhteydessä oleva lakisääteinen ehto.
Fimean rooli
Lääkkeiden arviointi sekä niiden valmistuksen ja jakelun asianmukaisuuden varmistaminen on Fimean perustehtävä, jota valvomme ja edistämme monin eri tavoin. Fimea myöntää myyntilupia ihmis- ja eläinlääkkeille sekä kansallisena päättäjänä että yhteistyössä muiden EU:n lääkeviranomaisten kanssa. Fimea myös valvoo lääkinnällisten laitteiden vaatimustenmukaisuutta ja alan toimijoita Suomessa. Lisäksi Fimea varmistaa apteekkipalveluiden riittävyyttä, lääkkeiden toimitus- ja jakeluvarmuutta sekä hintakilpailun toimivuutta kuluttajan aseman turvaamiseksi.
Fimea vaikuttaa aktiivisesti EU:n lääkestrategiaan ja -valvontaan. Vaikuttavalla valvonnalla varmistetaan lääkkeiden turvallisuus ja laatu sekä jakelun ja toimitusten asianmukaisuus. Tarkoituksenmukaisesti kohdennettu, tehokas ja vaikuttava lääkehuollon sekä lääkinnällisten laitteiden toimijoiden valvonta on perusta potilasturvallisuuden sekä ihmisten ja eläinten hyvinvoinnin varmistamisessa.
Fimean tavoite
Fimean tavoitteena on edistää kestävällä tavalla kansalaisten terveyttä ja hyvinvointia sekä varmistaa, että turvalliset, tehokkaat, laadukkaat ja edulliset välttämättömät lääkkeet ja rokotukset ovat kansalaisten saatavilla. Fimea pyrkii myös olemaan ensisijainen ja ajantasainen tiedonlähde saatavuushäiriöistä. Tavoitteena on, että lääkkeiden ja lääkinnällisten tuotteiden saatavuushäiriöt vaikuttaisivat kansallisella tasolla potilashoitoihin mahdollisimman vähän.
Miten tavoitteen saavuttamista edistetään Fimeassa
- Fimea arvioi ja myöntää ihmisille ja eläimille tarkoitettujen lääkevalmisteiden myyntilupia. Fimean tekemien arviointien määrä Euroopan lääkeviraston koordinoimien keskitettyjen myyntilupien vastuullisena raportoija- tai rinnakkaisraportoijamaana on viraston kokoon nähden merkittävä, mikä edistää Fimean kansainvälistä vaikuttavuutta. Fimea on edelläkävijä erityisesti biosimilaarien myyntilupien arvioinnissa: Suomi on arvioinut vuonna 2023 vastuullisena raportoijamaana biosimilaarien myyntilupahakemuksia EU-maista toiseksi eniten.
- Fimea painottaa strategiassaan rinnakkaisvalmisteiden saatavuuden turvaamista ja valikoiman lisäämistä. Fimea onkin jatkanut panostamistaan rinnakkaisvalmisteiden saatavuuteen toimimalla niiden osalta vastuullisena viitejäsenvaltiona merkittävässä osassa EU:n yhteisiä hakemuskäsittelyjä.
| Lääkevalmiste Järjestä taulukko sarakkeen mukaan nousevasti | 2018 Järjestä taulukko sarakkeen mukaan nousevasti | 2019 Järjestä taulukko sarakkeen mukaan nousevasti | 2020 Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|---|---|
| Ihmislääke | 9 224 | 9 515 | 9 584 | 9 867 | 10 059 | 10 311 |
| Eläinlääke | 1 030 | 1 080 | 1 131 | 1 163 | 1 192 | 1 215 |
| Yhteensä | 10 254 | 10 595 | 10 715 | 11 030 | 11 252 | 11 526 |
- Fimea kannustaa lainsäädännön avulla lääkkeiden kehittämistä lapsille, jotta lastenlääkkeiden saatavuus paranee.
- Fimea huolehtii seksuaali- ja lisääntymisterveyteen tarvittavien lääkevalmisteiden (kuten ehkäisy, lapsettomuuden ja sukupuolitautien hoito) saatavuudesta, mikä myös edistää sukupuolten tasa-arvoa ja yhdenvertaisuutta.
- Fimea valvoo lääkinnällisten tuotteiden vaatimustenmukaisuutta ja alan toimijoita. Laitteiden vaatimustenmukaisuuden valvonta koskee markkinoille saatettuja lääkinnällisiä laitteita sekä niiden ammattimaista käyttöä ja ylläpitoa. Fimea myöntää lääkinnällisille laitteille myynnin esteettömyystodistuksia, tutkimus- ja poikkeuslupia.
Lääkinnällisten laitteiden ilmoitetut laitokset
Ennen kuin lääkinnälliset laitteet pääsevät Euroopassa markkinoille, niiden tulee läpäistä EU-asetuksissa kuvattu vaatimuksenmukaisuuden arviointi. Toisin kuin lääkkeillä, CE-merkityillä lääkinnällisillä laitteilla ei ole viranomaisten myöntämää myyntilupaa, vaan niitä arvioivat ilmoitetut laitokset. Ilmoitetut laitokset ovat itsenäisiä toimijoita, jotka tekevät vaatimuksenmukaisuuden arviointia. Fimea nimeää Suomessa toimivat ilmoitetut laitokset ja valvoo niiden toimintaa.Ilmoitetut laitokset ovat kriittisessä roolissa markkinoille saattamisen prosessissa. Ne ovat tärkeä osa järjestelmää, jolla varmistetaan lääkinnällisten laitteiden saatavuutta, laatua ja turvallisuutta. Suomessa toimii tällä hetkellä kaksi lääkinnällisten laitteiden asetuksen (MDR EU 2017/745) mukaista ilmoitettua laitosta ja vuonna 2023 Suomeen saatiin myös kaksi in vitro diagnostiikka -asetuksen (IVDR EU 2017/746) mukaista ilmoitettua laitosta. Koko EU:ssa toimii 40 ilmoitettua laitosta MDR:n mukaisille laitteille ja 12 ilmoitettua laitosta IVDR:n mukaisille laitteille.
- Fimea valvoo ihmisperäisten valmisteiden, kuten veren ja verivalmisteiden, kudosten, elinsiirteiden ja pitkälle kehittyneissä terapioissa käytettävien lääkevalmisteiden (ATMP) turvallisuutta ja alan toimijoita. Fimea myöntää veri- ja kudoslaitosten toimiluvat ja vastaa laitosten säännöllisestä tarkastamisesta.
Tapausesimerkki: Verenluovuttajien hyväksymisperusteiden uudistaminen
Fimean uusittu määräys veripalvelutoiminnasta tuli voimaan lokakuussa 2023.Uudessa määräyksessä muutettiin verenluovutuksen soveltuvuuskriteerejä niin, että väliaikainen verenluovutuskielto miesten välisen seksin jälkeen poistettiin. Seksi uuden, vaihtuneen tai usean seksikumppanin kanssa aiheuttaa henkilölle aina neljän kuukauden väliaikaisen verenluovutuskiellon.
Lisäksi väliaikainen luovutuskielto asetettiin edelleen muun muassa tiettyjen infektioiden sairastamisesta tai niille altistumisesta, veriteitse tarttuvalle taudille altistumisesta sekä tietyistä rokotuksista.
Väliaikaisen luovutuskiellon poistamisella miesten välisestä seksistä on merkitystä kansalaisten yhdenvertaisuuden kannalta. Pitkäaikaisessa, vakiintuneessa parisuhteessa elävät henkilöt voivat nyt luovuttaa verta seksuaalisesta suuntautumisestaan riippumatta.
- Fimea myöntää muun muassa apteekkien sekä kansallisten lääketehdas- ja lääketukkukauppojen toimiluvat sekä tarkastaa toimijoita säännöllisesti. Kotimaan lääketehtaiden lisäksi Fimea tarkastaa lääketehtaita myös niin sanotuissa kolmansissa maissa, jotka maahantuovat lääkkeitä EU/ETA-alueelle. Jotta jokaista sektoria valvotaan riittävästi, Fimea seuraa eri toimijoiden tarkastusten lukumääriä vuositasolla.
| Vuosi Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|
| Lääketehtaat GMP | 30 | 31 | 34 |
| Veripalvelutoiminta | 4 | 6 | 5 |
| Sairaala-apteekit ja lääkekeskukset | 18 | 18 | 14 |
| Apteekit ja sivuapteekit | 28 | 36 | 55 |
| Lääketukkukaupat | 25 | 27 | 26 |
| Kudoslaitokset | 25 | 25 | 22 |
| Elinluovutus- ja elinsiirtotoiminta | 0 | 6 | 6 |
| Lääkinnällisten laitteiden valmistajien tarkastus | 9 | 9 | 19 |
| Lääkinnällisten laitteiden valtuutettujen edustajien, maahantuojien ja jakelijoiden tarkastus | 2 | 3 | 4 |
| Kliinisten laitetutkimuksien tutkimuspaikan tarkastus | 0 | 2 | 1 |
| Ilmoitettuun laitokseen kohdistuva vuosittainen valvonta | 3 | 3 | 3 |
| Sterilointipalveluiden tuottajaan kohdistuva tarkastus | 0 | 0 | 0 |
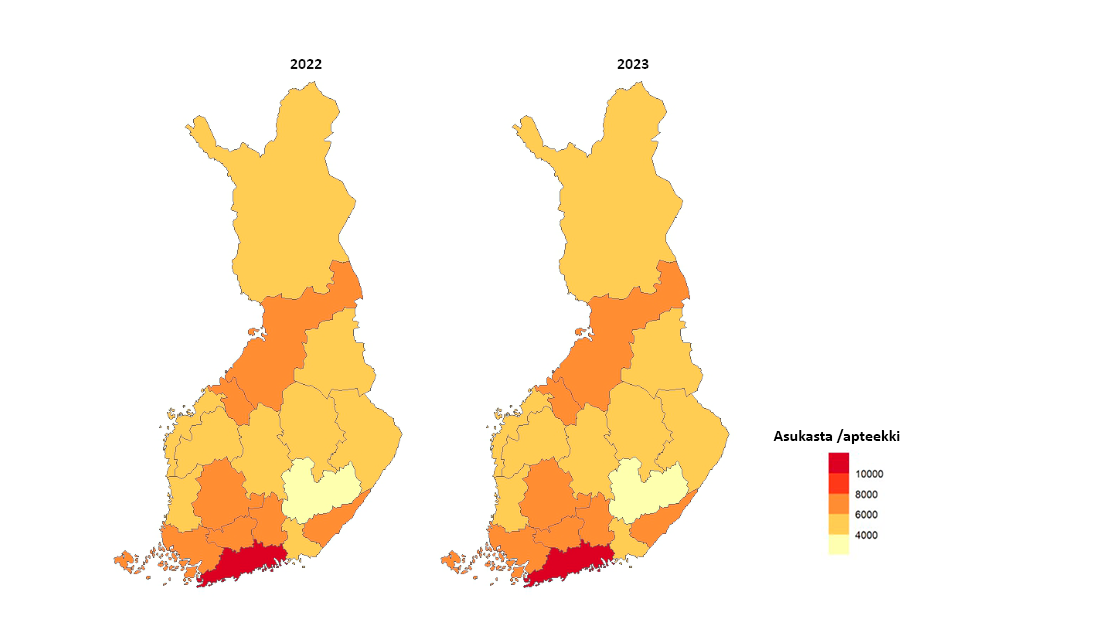
- Apteekkipalveluiden osalta toimijoiden määrä on Suomessa rajoitettu. Apteekit kehittävät uusia palvelumuotoja, esimerkiksi verkkoapteekkitoimintaa ja kotiinkuljetuspalveluita, jotka edistävät lääkkeiden saatavuutta. Fimea varmistaa, että Suomen apteekkiverkko on riittävän kattava eli apteekkiverkosto kehittyy asiakastarpeiden mukaisesti ja lääkkeitä on hyvin saatavilla myös syrjäseuduilla. Fimea arvioi vuosittain jakeluverkon kattavuutta ja seuraa, mikä on apteekkitoimipisteiden määrä asukasta kohden kunnittain. Suomessa toimi 31.12.2023 yhteensä 640 apteekkia ja 189 sivuapteekkia. 107 apteekissa vaihtui apteekkari ja seitsemään Fimean aiemmin perustamaan apteekkiin valittiin ensimmäinen apteekkari.
- Fimea huolehtii osaltaan terveydenhuollon tarvitsemasta kattavasta lääkevalikoimasta, seuraa myönnettyjen myyntilupien määriä ja lääkkeiden hintapolitiikkaa. Fimea esimerkiksi ylläpitää niin sanottua keskenään vaihtokelpoisten lääkevalmisteiden luetteloa. Vaihtokelpoiset lääkkeet sisältävät yhtä suuren määrän samaa vaikuttavaa lääkeainetta, jolloin lääke voidaan apteekissa vaihtaa halvimpaan vaihtokelpoiseen lääkkeeseen. Hinnaltaan edullisemmat valmisteet, kuten rinnakkaislääkkeet sekä biosimilaarit, mahdollistavat taloudellisesti kestävän lääkkeiden saatavuuden ja terveyshyödyn mahdollisimman laajalle väestölle. Huhtikuun 2023 alusta astman ja keuhkoahtaumataudin hoidossa käytettävät inhaloitavat lääkevalmisteet tulivat vaihtokelpoisiksi. Lääkevaihtoa tehostettiin valmisteiden välisen hintakilpailun lisäämiseksi, jotta lääkehuollon kustannustehokkuutta voidaan parantaa.
| Summa Järjestä taulukko sarakkeen mukaan nousevasti | 2017 Järjestä taulukko sarakkeen mukaan nousevasti | 2018 Järjestä taulukko sarakkeen mukaan nousevasti | 2019 Järjestä taulukko sarakkeen mukaan nousevasti | 2020 Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|---|---|
| Yhteensä, milj. euroa | 70,1 | 77,8 | 75,5 | 75,1 | 78,2 | 102,3 |
| Säästö/vaihto, euroa | 23,7 | 22,9 | 19,0 | 18,2 | 16,7 | 21,2 |
Lähteet: Kelan aineisto Sairausvakuutuksesta korvattavat lääketoimitukset. Hinta- ja viitehintatiedot Lääketietokannan tiedoista. Korvaukset sisältävät lisäkorvaukset. Tilasto kattaa myös ennen alkuomavastuun täyttymistä tehdyt ostot.
Lääkkeen vaihtamisen tuomat säästöt vuosina 2017-2022 saavutettavassa muodossa (pdf)
- Lääkeyrityksen vastuulla on vastata lääkkeen saatavuustiedosta ja markkinoille tuonnista. Fimea valvoo ja selvittää tarvittaessa lääkkeiden saatavuushäiriötapauksia lääkeyritysten kanssa. Fimea ylläpitää verkkosivuillaan ajankohtaisista saatavuushäiriöistä listaa, joka perustuu lääkeyritysten toimittamiin tietoihin. Vuonna 2023 Fimea otti käyttöön rekisterin ja sähköisen asioinnin lääkeyritysten saatavuushäiriöilmoitusten käsittelyyn. Vuoden 2024 aikana kehitetään lääkkeiden saatavuuden ja varautumisen tilannekuvan raportointia. Tietoja saatavuuden eri tietolähteistä, huomioiden myös saatavuushäiriöilmoitusten tiedot, kootaan raporteiksi kansallisten ja EU:n viranomaisten tarpeisiin.
Fimea vaikuttaa aktiivisesti Euroopan lääkeviraston (EMA) lääkkeiden saatavuudenhallinnan verkostoissa ja työryhmissä. Vuonna 2023 Fimea esimerkiksi osallistui EU:n kriittisten lääkkeiden luettelon laatimiseen, jonka avulla pyritään ennaltaehkäisemään potilashoidoille erityisen haitallisia toimitusongelmia. Lääke arvioidaan kriittiseksi, jos sitä käytetään vakavaan sairauteen, eikä sille löydy helposti korvaavaa lääkettä.
Fimea toimi vuonna 2023 EU-yhteistoimintahankkeen yhden osahankkeen vetäjänä. Fimean vetämän osahankkeen tavoitteena on saatavuushäiriöiden ennaltaehkäisy sekä potilasvaikutusten ehkäisy. Tavoitteena on harmonisoida lääkkeiden saatavuudenhallintaa lääkeviranomaisten kesken siten, että lääkkeiden saatavuushäiriöt vaikuttaisivat kansallisella tasolla potilashoitoihin mahdollisimman vähän.
Vuonna 2023 Fimeassa on myös tehostettu saatavuushäiriöihin ja lääkkeiden saatavuuteen liittyvän tiedon sisäistä jakamista. - Fimea osallistuu lääkinnällisten laitteiden saatavuudenhallinnan yhteistyöhön. Euroopan lääkevirasto EMA perusti kesäkuussa 2023 lääkinnällisten laitteiden saatavuuden hallinnan SPOC (Medical Device Shortages Single Point of Contact) -työryhmän (englanniksi), johon Fimea myös liittyi.
SPOC -työryhmä perustettiin antamaan suosituksia lääkinnällisten laitteiden saatavuudenhallinnan ohjausryhmälle MDSSG:lle (Excecutive Steering Group on Shortages of Medical Devices) asioissa, jotka liittyvät suoraan tai välillisesti lääkinnällisten laitteiden puutteisiin tai saatavuusongelmiin kansanterveydellisten poikkeustilanteiden aikana. Vuonna 2023 laitteiden saatavuushäiriöiden seurantaan ja raportointiin kehitettiin EU:n yhteinen käyttöliittymä. - Fimea valvoo lääkkeiden velvoitevarastointia, jonka tarkoituksena on turvata lääkkeiden saatavuus häiriötilanteissa, joissa lääkkeiden tavanomainen saatavuus maahamme on vaikeutunut tai estynyt esimerkiksi lääkkeiden toimituskatkosten tai vakavan kriisin takia. Tarvittaessa Fimea voi itse myöntää tai esittää sosiaali- ja terveysministeriölle myönnettäväksi lupia lääkeyrityksille velvoitevarastoinnin alitukseen katkeamattoman lääkevalmisteiden jakelun turvaamiseksi tai velvoitevarastoinnista vapautumiseen.
Velvoitevarastoinnin toteutumista valvotaan velvoitevarastointivelvollisten toimijoiden tarkastuksissa. Apteekeilla on velvoite varastoida tavanomaisen asiakaskuntansa kahden viikon kulutusta vastaava määrä lääkevalmisteita. Fimea valvoo tämän toteutumista apteekkien tarkastuksissa. - Fimea osallistuu kansalliseen varautumistoimintaan. Fimea osallistui Poikkeusolojen neuvottelukunnan (PONK) toimintaan sekä lääkkeiden että lääkinnällisten laitteiden osalta. PONK on sosiaali- ja terveysministeriön asettama neuvottelukunta, jonka tehtävänä on edistää sosiaali- ja terveydenhuollon sekä ympäristöterveydenhuollon poikkeusoloihin varautumista. Neuvottelukunta tekee esityksiä sellaisista sosiaali- ja terveydenhuollon normaaliolojen järjestelyistä, jotka tukevat toimintaa myös poikkeusoloissa.
- Fimea myöntää lääkehoidon katkeamattomuuden varmistamiseksi erityis- tai poikkeuslupia tilanteissa, joissa kriittistä myyntiluvallista lääkevalmistetta ei ole saatavilla Suomessa. Erityislupamenettelyllä turvataan yksittäisen potilaan lääkehoito poikkeustapauksessa myöntämällä erityisistä sairaanhoidollisista syistä lupa sellaiselle lääkevalmisteelle, jolla ei ole Suomessa myyntilupaa.
| Suorite Järjestä taulukko sarakkeen mukaan nousevasti | 2020 Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|
| Saatavuushäiriöilmoitukset | 2 093 | 1 710 | 2 335 | 2 849 |
| Velvoitevarastointipäätökset | 391 | 313 | 478 | 494 |
| Velvoitevarastoinnin alituslupapäätökset | 312 | 270 | 441 | 450 |
| Saapuneet poikkeuslupahakemukset (ihmislääkkeet)* | 198 | 125 | 175 | 200 |
| Poikkeuslupapäätökset (ihmislääkkeet)* | 189 | 107 | 152 | 186 |
| Saapuneet poikkeuslupahakemukset (eläinlääkkeet)* | 33 | 49 | 60 | 46 |
| Poikkeuslupapäätökset (eläinlääkkeet)* | 31 | 46 | 53 | 39 |
| Potilaskohtaiset erityislupapäätökset | 7 327 | 6 809 | 7 402 | 8 917 |
| Laitoskohtaiset erityislupapäätökset | 8 465 | 7 730 | 8 019 | 7 926 |
| Määräaikaiset erityislupapäätökset | − | − | 110 | 81 |
| Lääkinnällisiin laitteisiin liittyvät poikkeusluvat (MD-asetus ja IVD-asetus) | − | 1 | 14 | 10 |
Fimea seuraa eri suoritteita, jotka vaikuttavat lääkkeiden saatavuuteen, esimerkiksi saatavuushäiriöilmoituksia, lääkevalmisteiden velvoitevarastoinnin alituslupamääriä sekä poikkeuslupa- ja erityislupamääriä.
* Poikkeuslupien osalta laskentatapa on muuttunut, minkä vuoksi 2022-2023 lukemat eivät ole suoraan vertailukelpoisia aikaisempien vuosien määriin.
Lääkkeiden ja lääkinnällisten laitteiden saatavuuden hallintaan liittyvät suoritteet vuosina 2020-2023 saavutettavassa muodossa (pdf)